实验记录本 (Laboratory Notebook)
1 基本信息
- 课程名称 (Course) :CHEM UN3085 PHYSICAL AND ANALYTICAL CHEMISTRY LABORATORY I
- 实验编号 (Experiment No.) :3
- 实验标题 (Title) :燃烧焓的量热法测定:丁醇异构体与环张力研究 (Calorimetric Determination of Enthalpy of Combustion: A Study of Butanol Isomers and Ring Strain)
- 日期 (Date) :Sep 23 2025
2 实验目的 (Objective)
本实验旨在通过弹式量热法,测量并计算环丁醇分子中的环张力能。我们将精确测定三种醇(1-丁醇、2-丁醇和环丁醇)各自的摩尔燃烧焓(),然后通过比较这些燃烧焓的差异来最终确定环张力。
3 实验材料与仪器 (Materials & Equipment)
Thermistor-coupled MicroLAB ADC,
Thermocouple,
Parr Bomb Calorimeter.
Oxygen Bomb
1-丁醇 (1-Butanol):
2-丁醇 (2-Butanol):
环丁醇 (Cyclobutanol):
苯甲酸标准品 (Benzoic Acid Standard)
明胶胶囊 (Gelatin Capsules)
点火丝 (Ignition Wire):
4 实验步骤 (Procedure)
Part1 组装弹式热量计
步骤1
将铁丝剪切至合适长度(确保没有急弯)并精确称重(单位:克)。
步骤2
准备待测物质(约 0.8 克的苯甲酸压片,或约 0.4 克小心加入明胶胶囊中的液体丁醇)。
步骤3
使用 1.5V 干电池提供的电流加热铁丝,将其熔合到物质中。轻轻向铁丝吹气以防过热。压片或胶囊应位于中心位置。
步骤4
仔细称量与铁丝熔合后的样品。
步骤5
小心地安装样品和铁丝。样品应位于坩埚正上方,铁丝应只接触电极。
步骤6
小心地组装氧弹,并用手拧紧螺帽(不要使用扳手)。
步骤7
将氧弹连接到充氧装置,在拧紧前小心对齐接口。 a. 小心打开氧气主供气阀,缓慢向氧弹充气至 380 psi(不要超过 450 psi)。 b. 释放氧弹内压力,以冲洗掉弹内存在的大气氮。 c. 重新向氧弹充气至 380 psi。
步骤8
将氧弹浸入水中,仔细检查是否漏气。如果存在泄漏,需给氧弹放气,松开并轻微旋转弹头,重新拧紧螺帽,并重复步骤 7。每 秒一个气泡是无关紧要的。
步骤9
擦干氧弹,将其放入干燥的桶内,再将桶放入热量计中,确保其居中且不接触内壁。
步骤10
连接氧弹顶部的电极,并确保连接紧密。
步骤11
用 25°C 的水装满一个 2 升的烧瓶。小心地将水倒入桶中,并让其排尽约 30 秒。 a. 一个便捷的备水方法是同时使用热水和冷水,按需混合两者,边摇晃边用温度计检查,直到烧瓶装满。
步骤12
盖上热量计的盖子,将精密温度计尽可能低地夹住,但不要遮挡刻度。确保夹子不要太紧。桶内温度应在 25°C 的正负半度之内。
步骤13
在控制盒所有开关都关闭的情况下,将搅拌器和点火线的插头插入控制盒。
步骤14
将控制盒插入电源插座。
步骤15
短暂开启搅拌器,确保其运行平稳。
 图 1
图 1
弹式热量计(帕尔设计),图中展示了其绝热夹套,该夹套也可在空置时用作绝热空气夹套。精密水银温度计可由高分辨率电阻温度计或校准过的热敏电阻替代。
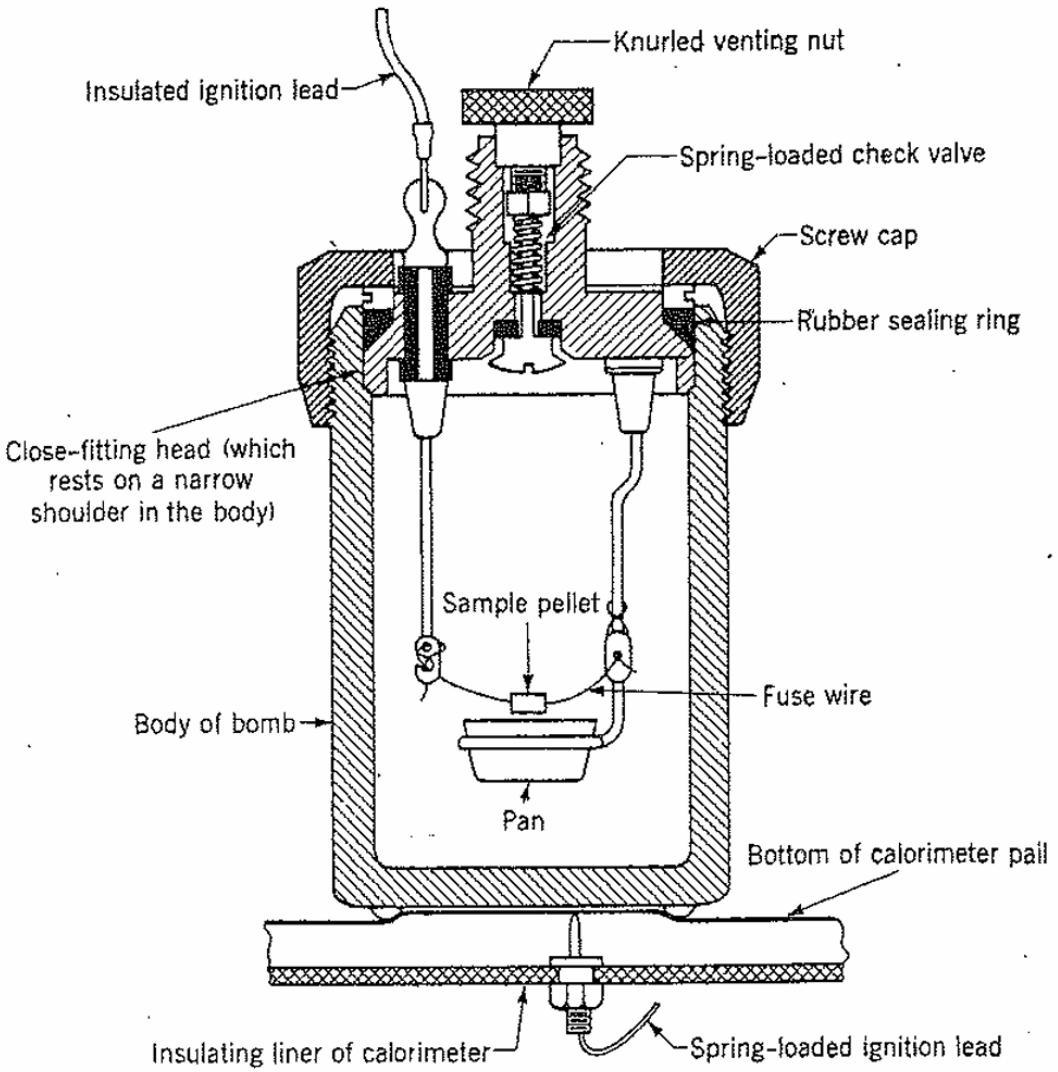
图 2 帕尔单阀氧弹,图中显示其与热量计桶底部接触。其中一个电触点通过桶身自动与氧弹主体连接。在装载样品时,应将氧弹安装在组装支架上。
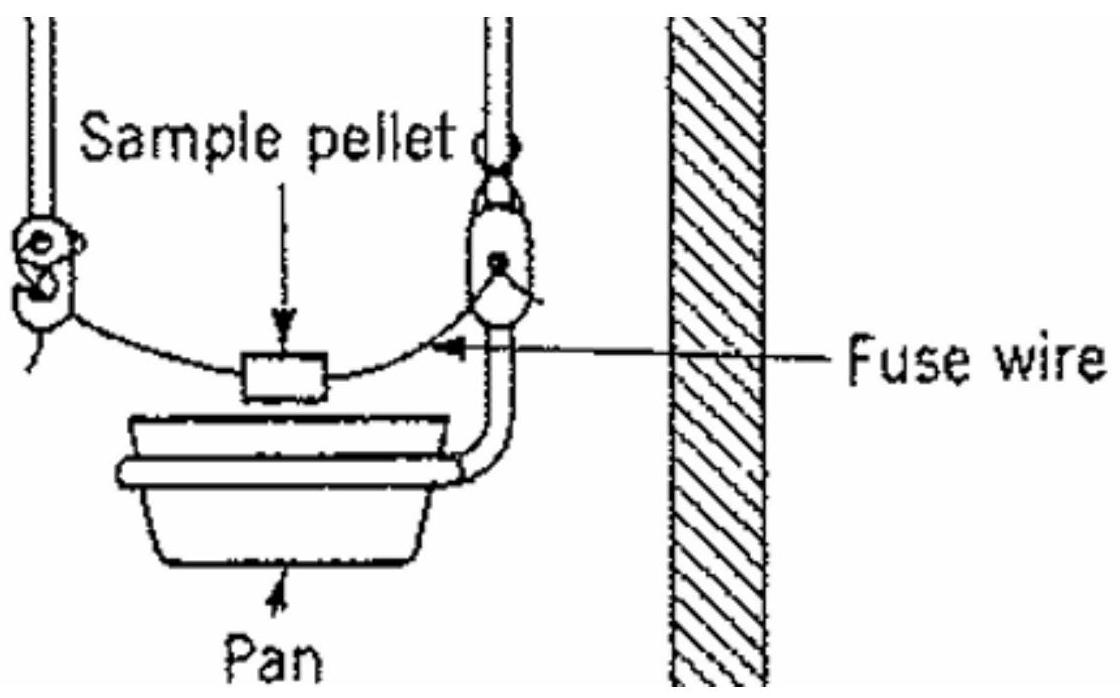
图3 样品在一个小金属坩埚中燃烧
Part2 进行实验操作
步骤1
每 30 秒记录一次时间和温度计上显示的温度,精确到 .001°C。 a. 每次读数前轻敲温度计。在实验结束前不要中断这些读数。务必每 30 秒记录一次时间和温度数据。
步骤2
热量计桶的温度应以非常线性的速率上升(大约每分钟 .001°C)。确保这种稳定的线性增长持续 5 分钟。
步骤3
打开点火开关后立即关闭以点燃氧弹。记录下这一发生的确切时间。 a. 指示灯可能会出现一次短暂的暗闪,这表示有电流通过以烧断铁丝。 b. 燃烧的铁丝将点燃样品,温度将在 秒后上升。 c. 几分钟后,桶内温度应恢复到缓慢而稳定的增长。 d. 不要停止时间和温度的测量。这些测量应持续进行,直到点火后的总时间至少是恢复到稳定速率所需时间的 倍。
步骤4
读数完成后,关闭所有开关并拔掉插头。
Part3 实验结束后
步骤1
拆卸装置,小心地释放氧弹压力,并打开氧弹。
步骤2
取出并称量任何未燃烧的铁丝。 a. 忽略“小球”,除非试图压碎它们时发现是熔融的金属而不是氧化物。
步骤3
用铁丝的原始重量减去未燃烧铁丝的重量,得到燃烧掉的铁丝的重量(单位:克)。
步骤4
如果氧弹内部覆盖有烟灰/黑色粉末,说明点火时的氧气量不足以使其完全燃烧,本次实验应作废。
步骤5
将所有氧弹部件擦拭干净。
5 实验原始数据表 (Raw Data Table)
表0:实验条件和常数
- 实验室环境温度 (T_ambient): __________ °C = __________ K
- 所用气体常数 (R): 8.314 J·mol⁻¹·K⁻¹
- 1-丁醇/2-丁醇摩尔质量 (): 74.12 g/mol
- 环丁醇摩尔质量 (): 72.10 g/mol
- 明胶胶囊比燃烧能 (): 4600 cal/g
表1:量热计能量当量的测定 (使用苯甲酸标准品)
| Run | 苯甲酸 质量 (g) |
铁丝 初始 质量(g) |
铁丝 终末 质量(g) |
铁丝质量差 (g) |
校正后 温升 (°C) |
总热量 (kJ) |
丝的热量 (kJ) |
BA 热量 (kJ) |
能量 当量 (kJ/°C) |
|---|---|---|---|---|---|---|---|---|---|
| 1 | |||||||||
| 2 | |||||||||
| 平均值 |
表2:丁醇同分异构体燃烧焓的测定
| 样品 | Run | 胶囊 质量 |
样品 +胶囊 质量 |
样品 质量 |
铁丝 初始 质量 |
铁丝 终末 质量 |
总 热量 |
胶囊 热量 |
样品 热量 |
醇的 摩尔数 |
|||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| (g) | (g) | (g) | (g) | (g) | (°C) | (cal) | (cal) | (cal) | (mol) | (cal/mol) | (cal/mol) | ||
| 1-丁醇 | 1 | ||||||||||||
| 2 | |||||||||||||
| 3 | |||||||||||||
| 2-丁醇 | 1 | ||||||||||||
| 2 | |||||||||||||
| 3 | |||||||||||||
| 环丁醇 | 1 | ||||||||||||
| 2 | |||||||||||||
| 3 |
For 温升 (°C):
| 点火 时间 |
点火 温度 |
结束 时间 |
结束 温度 |
初始 漂移率 |
最终 漂移率 |
面积 均衡 时间 |
|---|---|---|---|---|---|---|
| s | °C | s | °C | °C/s | °C/s | s |